De nombreux organismes vivants tels que les cyanobactéries, les algues unicellulaires et les plantes supérieures sont dénommés des organismes autotrophes, capables de produire eux-mêmes les composés organiques réduits nécessaires à leur développement. Quand l’énergie nécessaire à mécanisme provient de la lumière on parle d’organismes photoautotrophes, utilisant la photosynthèse (voir expérience 17. La photosynthèse) pour produire les composés organiques. La photosynthèse est légèrement différente entre les organismes eucaryotes et procaryotes mais dans les deux cas la lumière et le CO2 sont utilisés.
La machinerie photosynthétique nécessite des pigments pour capter l’énergie lumineuse. Chaque type de pigment est capable d’absorber des longueurs d’onde spécifiques du spectre lumineux visible et sont ainsi responsables de la coloration de la majeure partie des tissus vivants.
La composition en pigment présents chez un organisme photosynthétique dépend de sa position taxinomique : bactérie, algues ou plantes supérieures. Cette composition permet de retracer l’évolution des systèmes photosynthétiques et vont de pair avec la théorie endosymbiotique des chloroplastes, qui seraient issus de la phagocytose d’une cyanobactérie ancestrale.
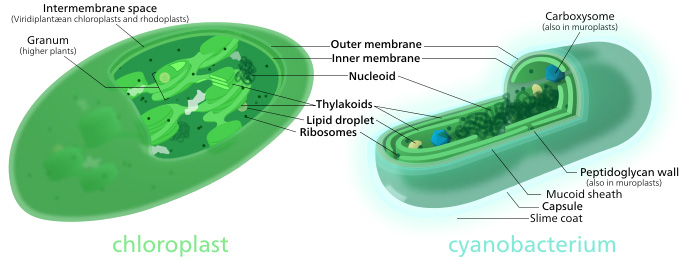
Comparaison de la morphologie d'un chloroplaste avec une cyanobactérie. Source: Wikipedia
Les principaux pigments impliqués dans la photosynthèse peuvent être séparés en trois grandes familles :
Les chlorophylles : Les chlorophylles sont des pigments verts, présent dans tous les organismes photoautotrophe. Ce sont les pigments les plus important du processus photosynthétique, également appelé pigments photosynthétiques. Leur coloration verte est due au fait qu’ils absorbent fortement le bleu et le rouge alors qu’ils réfléchissent le vert. Dans les plantes supérieurs, on retrouve deux types de chlorophylle, la chlorophylle a et la chlorophylle b.
Les caroténoïdes : Les caroténoïdes sont des pigments présentant une coloration jaune orangée. Ils sont capables d’absorber la lumière dans des régions du spectre où la chlorophylle absorbe faiblement et de transférer cette énergie lumineuse vers les pigments de chlorophylle. C’est ce que l’on appelle des pigments accessoires. Les caroténoïdes jouent également un rôle photoprotecteur en dissipant l’excès de lumière.
Les phycobillines : Les phycobillines sont des pigments principalement présents chez les algues rouges et les cyanobactéries. Comme les caroténoïdes, ce sont des pigments accessoires transférant l’énergie vers les chlorophylles. Ils sont divisés en deux grands groupes : Les phycoerythrines caractérisées par une coloration rouge et les phycocyanines donnant une coloration bleue et émettant une fluorescence rouge.Ce pigment bleu avait « faussement » donné le nom d’algues bleues aux cyanobactéries.
Thèmes : photosynthèse, pigments, évolution, endosymbiose, chromatographie, polarité,
EXPERIENCE
L’expérience proposée permet de séparer, visualiser et comparer des pigments présents dans 3 organismes photosynthétiques différents:
- Une plante supérieure, le persil (Petroselinum crispum)
- Une algue verte unicellulaire, la chlorelle (Chlorella regularis)
- Une cyanobactérie, la spiruline (Arthrospira platensis)
PROTOCOLE
Extraction des pigments
Le matériel utilisé est composé de persil séché (disponible dans les rayons alimentaires de tous les magasins), de pilules de spiruline (disponible en pharmacie ou magasin Bio) et de poudre de chlorelle (disponible en magasin Bio).

1) Préparation de la poudre
- Peser 1 g de chacune des préparations (Spiruline, Chlorelle et persil)
- A l’aide d’un mortier et d’un pilon, réduire chacune des préparations en fine poudre.

2) Solubilisation des pigments
Pour la chromatographie
- Prendre 3 tubes 15 ml et ajouter 2 ml d’éthanol dans chacun des tubes.
- Peser 500 mg de poudre et les transférer dans le tube 15 ml, préalablement annoté avec le nom de l’organisme. Procéder de même pour les trois organismes.
- Fermer les tubes et les mélanger vigoureusement jusqu’à ce que la totalité de la poudre soit dissoute.
- Entre ouvrir légèrement le capuchon des tubes et disposer les tubes sur un portoir dans un bain marie à 75-80° C. Laisser chauffer 2 minutes.
- Sortir les tubes du bain marie, fermer les bouchons et laisser les reposer pendant 10 minutes.
Si vous ne possédez pas de bain-marie, vous pouvez parfaitement, à l’aide d’une plaque chauffante, chauffer 200 à 250 ml d’eau dans un bêcher. L’eau doit être proche du point d’ébullition, environ 80°.

Pour l’observation de la fluorescence
- Prendre un nouveau tube 15 ml et le remplir avec 13 ml d’eau distillée.
- Ajouter une pastille de Spiruline et refermer le tube. NE PAS AGITER
- Laisser le tube sur un portoir jusqu’à la fin de l’expérience sans le bouger.
Chromatographie sur couche mince
La chromatographie sur couche mince est une technique analytique principalement utilisée pour séparer des substances colorées non volatiles, comme les pigments biologiques. La séparation s’effectue grâce à la migration, par capillarité, d’un solvant sur une plaque de chromatographie.
Un mélange de pigments peut être séparé en fonction de la différence d’affinité de chacun des pigments pour le substrat sur lequel ils sont placés ainsi que par leur degré de solubilité (défini par la polarité) dans le solvant utilisé.
Dans notre cas, les pigments avec une faible polarité, donc soluble dans notre solvant, vont migrer vers le haut de notre plaque, tandis que les pigments avec une grand polarité, soit peu ou pas soluble vont rester au départ de notre plaque
3) Préparation des plaques de chromatographie
- Pendant les 10 minutes de repos, commencer la préparation des plaques de chromatographie.
- Prendre un plaque de silice et la placer en long devant vous (le plus petit côté vers vous).
- A l’aide d’un crayon, tracer délicatement une ligne à 1,5 cm du bas.
- Sur cette ligne, marquer ensuite 3 points à distance égale.

4) Préparation du solvant pour chromatographie (par le préparateur/enseignant)
Nous fournissons un mélange de solvants prêt à l’emploi. Ce mélange contient de l’éther de pétrole et de l’acétone (5:1) , optimisé afin de diminuer la toxicité tout en garantissant une bonne séparation des pigments. Il doit être manipulé exclusivement par l’enseignant ou le personnel technique mais pas par l’élève. Idéalement sous une hotte chimique. Si cela n’est pas possible l’enseignent veillera à éviter tout évaporation et à ventiler la salle. Ce solvant est inflammable !. A la fin de l’expérience l’excès de solvant, s’il n’est pas évaporé sous une hotte chimique, doit être récupéré (tube plastique de 50 mL fourni) et rendu à BiOutils qui se chargera de son élimination.
- Disposer les cuves sous une hotte chimique. Si vous n’en possédez pas, les disposer sur une table à part et veillez à bien ventiler la pièce.
- Verser la totalité d’un tube (12 ml) dans chacune des cuves de chromatographie.
5) Migration des pigments
Récupérer vos tubes 15 ml sans trop les agiter. Vous pouvez observer 2 phases : la phase supérieure, que nous allons utiliser pour la suite, contenant les pigments dissouts dans l’éthanol et la phase inférieur contenant les débris cellulaires.
- A l’aide de la P20, prélever 3 µl (phase supérieure) de l’extrait de Spiruline et les déposer sur le premier point de plaque de silice. Attention à ne pas la toucher avec la pointe.
- Faites de même avec les deux autres organismes en le déposant à la suite.
- Laisser sécher 1 minute
- Déposer à nouveau 3 µl sur les mêmes spots.
- Laisser sécher encore 1 minute.
- Prendre la plaque par le haut à l’aide des pinces et la déposer dans la boite contenant le solvant.
- Fermer la boite et laisser migrer jusqu’à ce que le solvant soit arrivé à 1 cm du haut de la plaque (8-10 minutes)
- Toujours à l’aide des pinces, retirer la plaque de la boite et la laisser sécher 3-4 minutes.
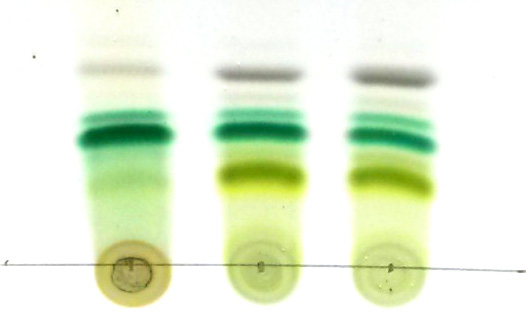
- Prendre une photo et observer les résultats.
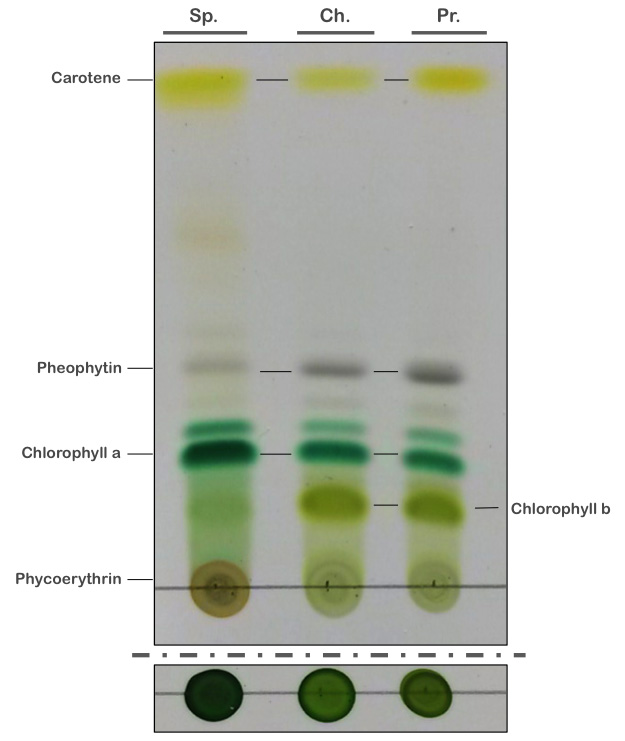
6) Analyse des résultats
-
En bas de la CCM, la phycoérythrine (rouge) est visible. Celle-ci, à cause de sa haute polarité, reste fortement associée à la TLC et ne migre pas. La phycoérythrine est présente chez les cyanobactéries et les algues rouges (pas testé ici). A noter que la phycocyanine (pigment bleu des cyanobactéries) n’est pas extraite dans l’éthanol et donc non présente sur la TLC. Elle est en revanche soluble dans l’eau et visible dans l’expérience ci-dessous. Ces pigments, absents chez les algues vertes et les plantes supérieures, semblent avoir été perdu pendant l’évolution des chloroplastes.
-
La chlorophylle a est clairement visible chez tous les organismes photosynthétiques. La chlorophylle b, en revanche est absente chez les cyanobactéries. Cependant une très légère bande visible à la hauteur de la chlorophylle b est quelque fois visible. Il s’agit de molécules de chlorophylle a altérées, d’autres pigments ou de contaminants d’algues vertes souvent présents dans les cultures de spirulines.
-
La phéophytine correspond aux molécules de chlorophylles sans l’atome de magnésium central dans le noyau porphyrine. Une faible quantité de phéophytine existe naturellement et participe aux transferts d’électron durant le processus de de photosynthèse. Elle également un produit de dégradation de la chlorophylle
- Les carotènes se retrouvent en haut de la CCM. D’autres pigments peuvent également être visualisés entre les carotènes et la phéophytine.
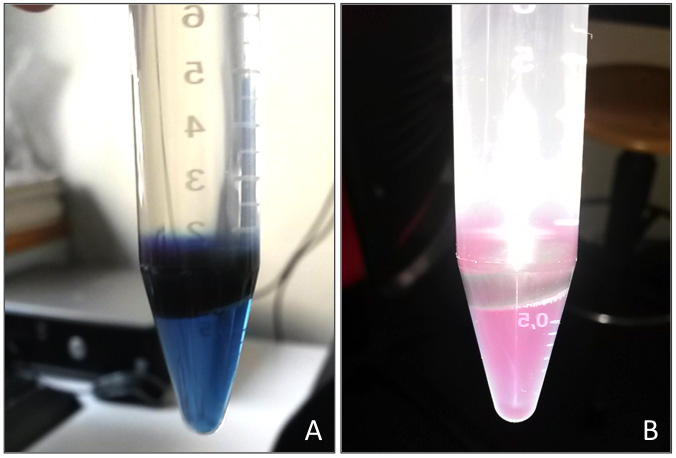
7) Fluorescence de la phycocyanine
La phycocyanine est soluble dans l’eau mais insoluble dans l’éthanol. Ce pigment bleu peut facilement et magnifiquement être observable à l’œil nu en solution aqueuse (fig.A). Après illumination le pigment va émettre de la fluorescence dans le rouge, visible sur une photo prise avec le flash d’un smartphone (fig.B)
- Récupérer le tube 15 ml sans trop l'agiter.
- Observer le tube à la lumière et prendre une photo (sans le flash)
- Illuminer ensuite le tube avec une intense source lumineuse (les lampes LED des smartphones marchent très bien) et prendre une photo (avec flash)
Un protocole détaillé contenant plus d'informations est disponible en anglais sur le lien suivant.
Matériel fourni:
- Plaque de silice
- Micropipettes P20
- Boîte de pointes jaunes
- Solvant pour chromatographie
- Tubes plastique 15 ml
- Portoir tube 15/50 ml
- Ethanol 100%
- Cuves pour chromatographie
Matériel non fourni:
- Poudre Spiruline
- Poudre Chlorelle
- Poudre persil
- Balance
- Mortier/pilon
- Bain-Marie
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.