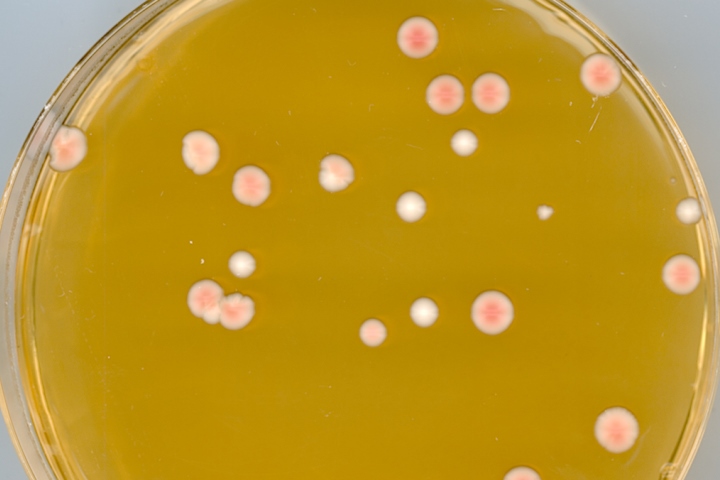
Cette expérience permet d'illustrer clairement les effets néfastes des UV et leurs conséquences sur la peau lors d'abus d'exposition au soleil. Le message du Docteur Jean-Pierre Grillet nous rappelle quelques chiffres. Un sujet à discuter en classe pour une meilleure prévention.
L'irradiation par les rayons ultraviolets (UV) provoque la formation de nombreuses modifications de l'ADN et est responsable de la majorité des cancers de la peau. Selon leurs longueurs d’onde les rayons UV sont classés en 3 catégories :
-
Les UVA (320-400 nm). Ce sont les moins énergétiques. Ils induisent cependant des modifications de l’ADN de manière indirecte.
-
Les UVB (280-320 nm). Ils pénètrent profondément dans les tissus et sont directement absorbés par l’ADN. Ils induisent la formation de dimère de pyrimidine. La plus grande partie du pouvoir cancérigène de la lumière solaire est due aux UVB.
-
Les UVC (200-280). Ce sont les plus énergétiques. Ils sont cependant absorbés par la couche d’ozone et n’atteignent pas la surface de la Terre. Ils forment des modifications similaires aux UVB sur l’ADN.
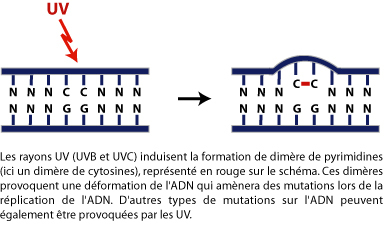
La photolyase est une enzyme activée par la lumière du jour qui permet de réparer les dimères de pyrimidine. Ce processus de réparation est dénommé la photoréversion. La photolyase existe chez presque tous les organismes vivants exceptés les mammifères euthériens (à placenta) tel que l’humain (dommage !). Les UV induisent également plusieurs autres types de mutations "ponctuelles" ainsi que des réarrangements des chromosomes.
Thèmes: Mutations, UV, courbe de survie, biosynthèse de l’adénine, gène ade2, photoréversion
L'EXPERIENCE:
L’effet de la survie des levures après différents temps d’exposition aux UV va être déterminé. Nous utilisons une souche de levure qui porte une mutation dans le gène ADE2 impliqué dans la biosynthèse de l’adénine. Ces cellules sont pigmentées en rouge par un processus décrit dans l’expérience 6. Après exposition aux UV, il sera également possible d'observer l’apparition de mutants se caractérisant par une coloration blanche des colonies. Ces mutants peuvent être :
- Des révertants vrais: la séquence sauvage au site de la mutation primaire est restituée.
- Des pseudo-révertants: une mutation secondaire dans le gène permet de synthétiser l'adénine.
- Des mutations dans des gènes d'ARN de transfert (permettant l'insertion d'un acide aminé correct au site de la mutation).
- Des mutations extragéniques : en général des mutations dans des gènes en amont du gène ADE2 dans la synthèse de l'adénine. Il y a donc plus de synthèse du produit s’oxydant en pigment rouge.
- Des mutations qui touchent la respiration (les mitochondries). Les levures affectées dans la respiration sont toujours capable de croître par fermentation, cependant la pigmentation rouge n’apparaît pas en absence de respiration. (voir l'effet de l'anaérobie dans le protocole 6).
Dans les trois premiers cas, la souche deviendra Ade+ et sera donc capable de croître sur un milieu sans adénine. Dans les deux derniers cas la souche restera Ade-.
Protocole :
1) préparation de la suspension de levure
- Prélever une colonie de levures ade2 bien rouge à partir de la boîte que l’on vous a fournie et la mettre en suspension dans 10 ml d’H2O stérile.
- Vortexer la suspension pour bien resuspendre les levures.
- En principe 1 colonie de levure dans 10 ml d’H20 donne une concentration d’environ 1 million de levures / ml. Pour déterminer précisément la concentration de levures, prélever 10 µl de la suspension et dénombrer les levures à l’aide de la cellule de Kovas.
- Diluer (environ 1000 fois) la suspension afin d’obtenir environ 1000 levures / ml
2) Etalement des levures sur 5 boîtes YPD
Par boîte :
- Vortexer la suspension de levure (à 1000 levures/ml). Il est important de vortexer juste avant de pipeter car les levures sédimentent rapidement.
- Pipeter 100 µl de la dilution et les déposer sur une boîte YPD
- Etaler les 100 µl à l’aide d’un râteau stérile.
3) Mutagenèse
Eviter les "coups de soleil" sur les mains en portant des gants.Porter des longues manches pour protéger les avant-bras.Porter des lunettes de protection
- Mettre des gants et des lunettes de protection anti-UV. Porter des longues manches.
- Allumer la lampe UV (position 254 nm)
- Mettre une boîte sous les UV. Enlever le couvercle. Enlever vos mains de dessous les UV et déclencher le chronomètre.
Remarque: La lampe UV s’arrête automatiquement après 10 minutes d’irradiation. Si vous la laissez allumée en continu il conviendra de la redémarrer toutes les 10 minutes.
Une option plus simple est d’enclencher la lampe UV uniquement pendant l’irradiation. Ces lampes ne nécessitent pas de préchauffage pour avoir un effet sur les levures.

-
Après 10 secondes remettre le couvercle et enlever la boîte des UV.
-
Marquer 10 secondes sur le dos de la boîte.
-
N’exposer pas la boîte à une trop forte intensité de lumière visible après la mutagenèse afin d’éviter la photoréversion.
-
Refaire les mêmes étapes en exposant les autres boîtes pendant 20, 30 et 40 secondes respectivement. Marquer les durées d’exposition aux UV aux dos des boîtes.
-
La cinquième boîte ne sera pas exposée aux UV (marquer 0 seconde au dos de celle-ci). Il s’agit du témoin de l’expérience.
-
Incuber les boites à l’envers pendant 5 à 7 jours à 30°C (ou éventuellement) à température ambiante.
4) Alternatives possibles :
a) Tester l’efficacité de différentes crèmes solaires
- Procéder comme pour les étapes 1 et 2.
- Enlever le couvercle, tendre un film alimentaire dessus et le maintenir avec un élastique.
- Sur 4 boîtes étaler 4 crèmes différentes (d’indice UV, ou de marques différentes). Essayer de ne pas mettre une couche trop épaisse. L’important est que celle-ci soit répartie de manière uniforme (éventuellement essuyer le surplus avec un mouchoir en papier).
- La cinquième boîte contiendra le film alimentaire sans crème solaire. Il s’agira du témoin de l’expérience.

b) Déterminer le taux de photoréversion
- Préparer 3 boîtes YPD comme décrit dans les étapes 1 et 2
- 2 boîtes sont exposées aux UV pendant 30 secondes comme décrit dans l'étape 3
- Exposer une boite à une forte lumière visible (lumière du soleil ou sous une forte lampe) tout de suite après l'exposition aux UV.
- Protéger l'autre boîte de la lumière pendant 15 minutes après la mutagenèse.
- La troisième boîte n'est pas exposée sous les UV. Il s'agit du contrôle de l'expérience.
- Incuber les 3 boîtes à 30°C pendant 5 à 7 jours.
5) Résultats
- Compter le nombre total de colonies sur chaque boîte.
- Tracer le graphique du nombre de colonies en fonction du temps d’irradiation (courbe de survie)
- Compter le nombre de colonies blanches sur chaque boîte.
- Tracer le graphe du nombre de mutants (colonies blanches) par rapport au nombre total de colonies sur la boîte. (courbe de mutations).
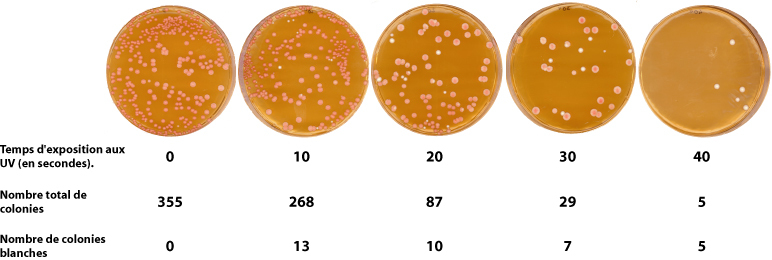
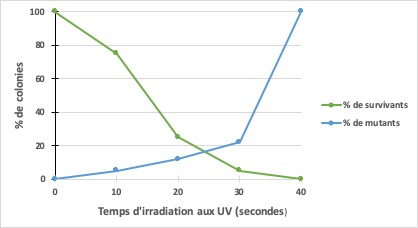
| En vert : Taux de survie en %. Le 100% correspond au nombre de colonies obtenues sans exposition aux UV (t=0). En blue, courbe du taux de mutants en % (colonies blanches par rapport au nombre de survivants) |
Pour l’efficacité́ des crèmes solaires, comparer et discuter les résultats obtenus avec les différentes crèmes.
Pour le test de photoréversion, comparer le nombre de colonies (et leurs aspects) obtenu avec et sans exposition à une forte lumière visible.
6) Pour ceux qui désirent continuer...
Comme décrit plus haut, certains mutants peuvent être devenus capables de croître sur un milieu sans adénine. De manière à déterminer la proportion de ceux-ci, il suffit de repiquer les colonies blanches sur des boîtes sans adénine. Pour cela on pose la boîte SD sans adénine sur une grille de réplique (feuille de papier contenant une grille numérotée) afin de se repérer sur la boîte et de facilement dénombrer les colonies repiquées. Procéder de la manière suivante :
- Piquer un cure-dent stérile dans une colonie blanche.
- Repiquer ce cure-dent sur une boîte SD sans adénine au-dessus de la case 1 de la grille de réplique.
- Jeter le cure-dent dans un bac.
- Prendre un nouveau cure-dent stérile et piquer dans une deuxième colonie blanche.
- Repiquer ce cure-dent sur une boîte SD sans adénine au-dessus de la case 2 de la grille de réplique.
- Et ainsi de suite avec toutes les colonies blanches.
- Inclure un contrôle négatif (une colonie rouge) par boîte.
- Marquer le fond de la boîte et l’incuber à l’envers à 30 °C pendant 2 à 3 jours.
Noter le nombre de colonies capables de pousser par rapport au nombre total de colonies repiquées. Discuter les résultats.
Attention, le nombre de colonies devenues capables de croître sans adénine dans le milieu est très faible. Il convient alors de repiquer beaucoup de colonies blanches (toutes si possible). Une autre alternative est de faire des répliquats sur boîtes sans adénine à l'aide du bloc de réplique. Cette méthode est plus rapide mais nécessite néanmoins plus de boîtes.
Matériel fourni:
- Boîtes de Petri YPD
- Lame Kovas
- Souche de levure ade2
- Lampe UV
- Lunettes de protection
- Micropipettes P200
- Boîte de pointes jaunes
- Boîte pipettes Pasteur pour les étalements
- Rack de 48 tubes stériles pour dilutions
- Bouteille d'eau stérile
- Portoirs pour tubes en verre
- Vortex
- Pipettes plastique 10 ml stériles
- Sac jaune pour les déchets
Matériel non fourni:
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.