Les bactéries se multiplient par fission binaire, de manière asexuée. Une cellule mère va donner deux cellules filles génétiquement identiques, ainsi le brassage génétique est pratiquement inexistant. Pour pallier à cela, il existe 3 mécanismes majeurs de transfert horizontal de gènes :
- la transformation : incorporation d’ADN nu de l’environnement directement dans la bactérie
- la transduction : transfert de matériel génétique d’une bactérie à une autre par l’intermédiaire d’un phage
- la conjugaison : transfert d’ADN d’une bactérie à une autre par contact direct.
Le transfert horizontal joue un rôle majeur de la diversité bactérienne, mais est également une des causes de l’augmentation des résistances aux antibiotiques et de la propagation de facteur de virulence.
L’expérience proposée ici va permettre d’illustrer ce mécanisme de conjugaison. Cette méthode permet le transfert unidirectionnel d’ADN plasmidique ou chromosomique entre deux bactéries. Ce processus nécessite un contact, par l’intermédiaire de pili sexuels, entre une bactérie donneuse et une bactérie receveuse.
Le mécanisme de conjugaison a été mis en évidence pour la première fois en 1946 par Joshua Lederberg et Edward L. Tatum, deux scientifiques américains. Lederberg était persuadé que le transfert de matériel génétique chez les bactéries ne se faisait pas uniquement par multiplication cellulaire. Pour étayer son hypothèse, il mit en place une expérience en mélangeant, en milieu liquide, deux mutants d’E.coli, le premier étant déficient pour la synthèse de thréonine, leucine et thiamine, le second déficient pour la synthèse de la biotine, de la phénylalanine et de la cystéine. Après quelques heures, il étala la culture sur un milieu minimum (sans thréonine, leucine, etc). 24 heures après, il a pu observer la croissance de centaines de colonies, qui ne pouvaient être autre que Thr+, Leu+, Thiamine+, Biotine+, Phé+, et Cys+, (voir schéma de l’expérience ci-dessous). Lederberg avait vu juste, les résultats de ces recherches ont été publiés dans Nature en 1946.
« Gene recombination in Escherichia coli » J. Lederberg, E.L. Tatum, Nature, Vol 158, 19 octobre 1946
Cette découverte lui a d’ailleurs valu le Prix Nobel de médecine en 1958.
Lien découverte conjugaison : http://www.medecine.unige.ch/enseignement/dnaftb/18/concept/index.html
Expérience de Lederberg
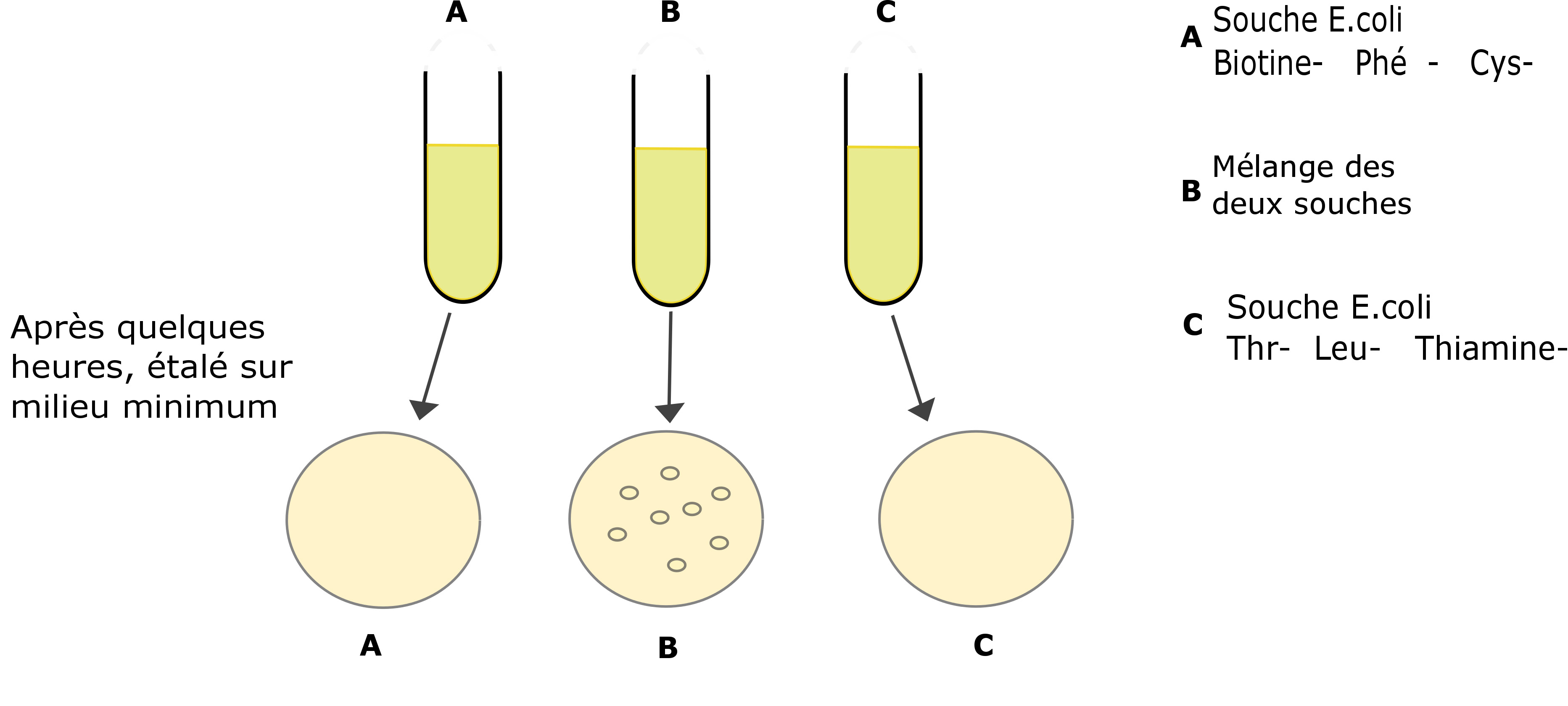
Les deux mutant d’E.coli (boite A et C) sont déficients pour certains facteur de croissance, les empêchant ainsi de pousser sur un milieu minimum (qui ne contient pas de biotine, thiamine, Leu, Thr, Phé et Cys). Sur la boite B, on observe quelques colonies. On peut donc dire que ces conjuguant ont récupéré les gènes du type sauvage, sans déficience dans les facteurs de croissance et ce par recombinaison homologue.
Facteur F
Le facteur de fertilité ou facteur F est le premier plasmide conjugatif mis en évidence chez les bactéries. Il porte un grand nombre de gènes parmi lesquels nous retiendrons :
- Gènes pour la synthèse de pili sexuels, permettant à une bactérie donneuse F+ (possédant le plasmide) de s’amarrer à une bactérie receveuse F- (ne possédant pas le plasmide)
- Gènes permettant la synthèse et le transfert de l’ADN d’une bactérie à une autre.
Le contact entre la bactérie donneuse (F+) et la bactérie receveuse (F-), réalisé grâce aux pili sexuels, est suivi par la formation d’un pont cytoplasmique permettant le transfert de l'ADN. Le transfert débute au site appelé "origine de transfert" (oriT) et se déroule selon un mode de cercle roulant.
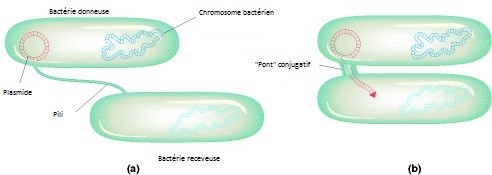
An introduction to Genetic Analysis. 7th dition. Griffiths AJF, Miller JH, Suzuki DT, et al 2000
Dans l’expérience de Lederberg, le plasmide F s’est intégré, dans de très rares cas, dans le génome de la bactérie receveuse, lui conférant ainsi de nouveaux gènes sauvages.
Bactérie Hfr
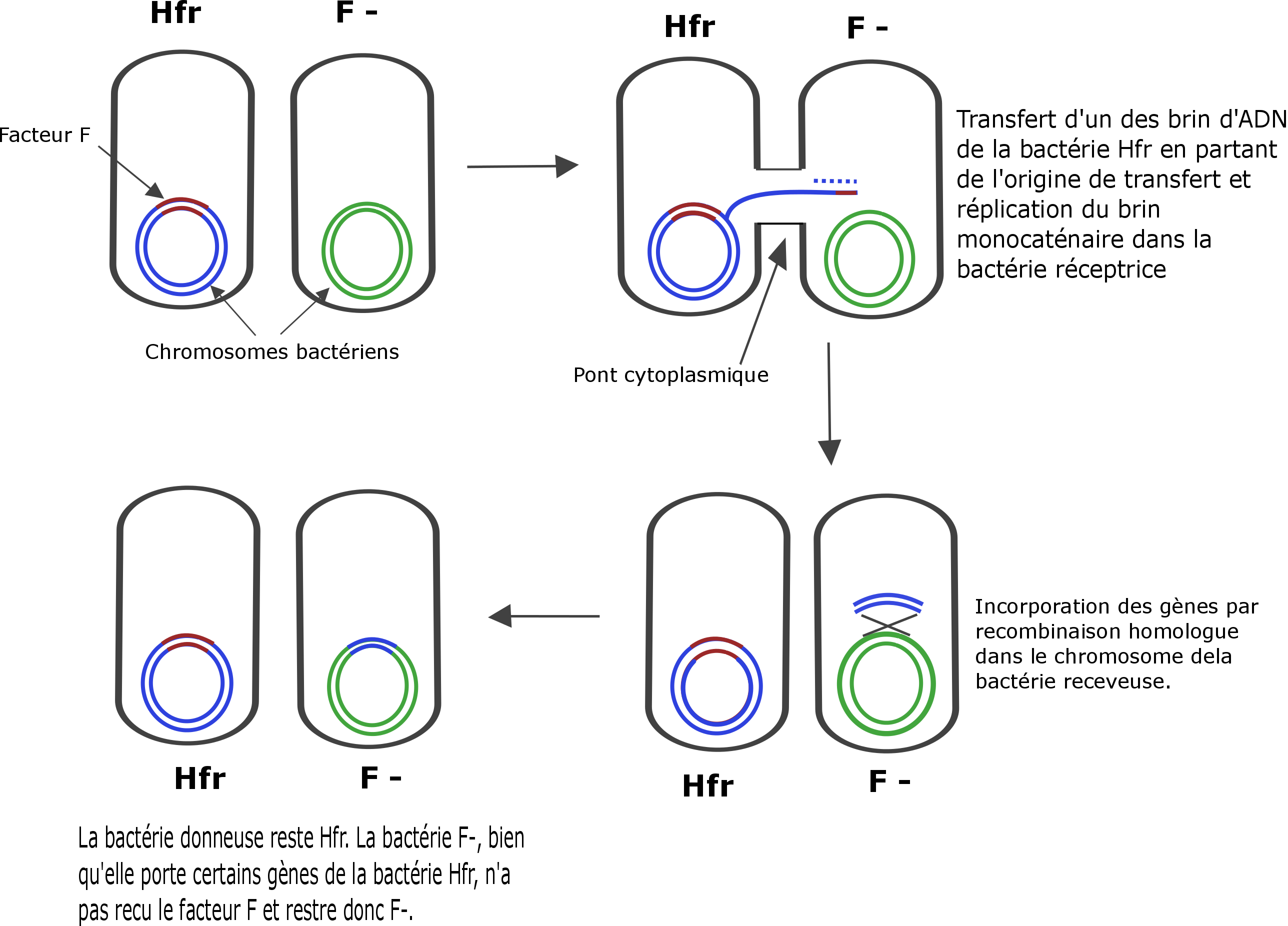
Le plasmide F étant capable de s’intégrer sur le chromosome bactérien, une bactérie portant le facteur F sur son propre chromosome est appelée Hfr (haute fréquence de recombinaison).
Lors d’un croisement entre une bactérie Hfr et une bactérie F-, le transfert et la réplication de l’ADN (chromosomique) commence au niveau de l’origine de transfert (oriT). Les différents gènes seront transférer l’un après l’autre et c’est uniquement lorsque l’ensemble du chromosome est transféré (environ 2 heures) que le facteur F est transféré lui aussi entièrement. Il est cependant très rare que l’ensemble du chromosome soit transmis, ainsi la bactérie receveuse ne reçoit pas le facteur F et reste donc F-. Elle a pu cependant acquérir, par recombinaison homologue, une partie des gènes de la bactérie donneuse.
Schéma d'un croisement d'une bactérie Hfr avec une F-
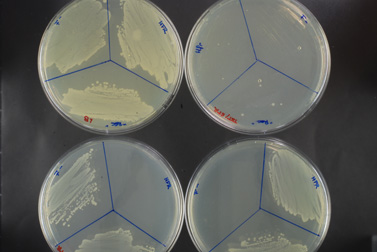
L’EXPERIENCE
Dans cette expérience, nous allons effectuer un croisement entre deux souches d’E.coli. La bactérie Hfr, ayant le facteur F sur son chromosome, possède également un gène de résistance à la tétracycline. La souche F- est résistante à la streptomycine.
Manipulation à effectuer par l'enseignant:
La veille du cours :
- Inoculer 10 ml LB avec la souche Hfr (donneuse)
- Inoculer 10 ml LB avec la souche F- (receveuse)
Le jour du tp :
- Préparer des aliquots de 10 ml de milieu LB et les mettre à 37°
- Préparer des aliquots de 500 µl pour chacune des souches et noter les tubes Hfr (pour la donneuse) et F- (pour la receveuse)
PROTOCOLE
Vous allez recevoir deux tubes 1,5 ml contenant deux cultures d’E.coli, une souche donneuse (tube Hfr) et une souche receveuse (tube F-)
- Prenez 3 tubes 14 ml et notez-les « Hfr », « F -» et « conjugaison »
- Mettre 4 ml de milieu LB (à 37°) dans les tubes Hfr et F-.
- Ajouter 300 µl de la préculture Hfr dans le nouveau tube Hfr.
- Ajouter 300 µl de la préculture F- dans le nouveau tube F-
- Fermer les tubes et mélanger pas inversion.
- Dans le tube « conjugaison », mettre 1 ml de la nouvelle culture Hfr et 1 ml de la nouvelle culture F-.
- Fermer le tube, mélanger par inversion.
- Mettre le tube « conjugaison » à 37° sans agitation et laissez incuber environ 60 minutes.
Pendant ce temps, prenez une boite de chaque antibiotique (Tet, Str et Tet/Str) et une boite LB.
- Prendre une des boites. A l’aide d’un marker, tracer sur le fond de la boite un cadran de tel sorte qu’elle soit séparée en trois parties. Noter ces trois parties, Hfr, F- et conjugaison.
- Faites de même avec les trois autres boites.
Une fois les 60 minutes écoulées :
- Récupérez votre tube de culture « conjugaison » et vos tubes Hfr et F-
- Tremper une pointe bleue dans la culture Hfr et strier en zigzag la partie correspondante de chaque boite antibiotique et de la boite LB.
- Faire de même avec les cultures F- et conjugaison.
- Prenez une seconde boite contenant les deux antibiotiques et déposer 100 ul de la culture « conjugaison ». Etaler à l’aide d’un râteau.
- Refermer vos boites et les incuber à l’envers à 37° toute la nuit.
Analyse des résultats:
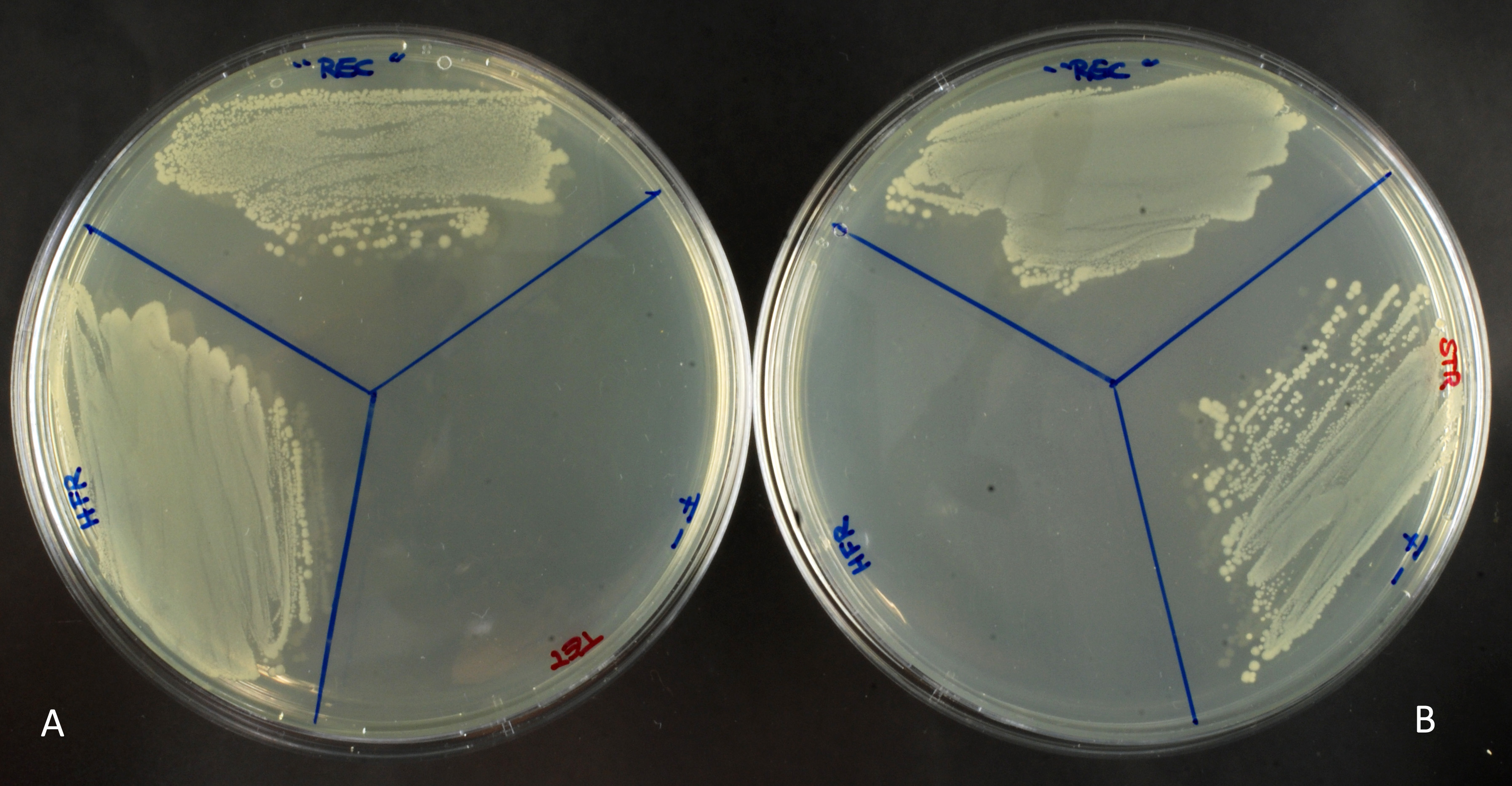
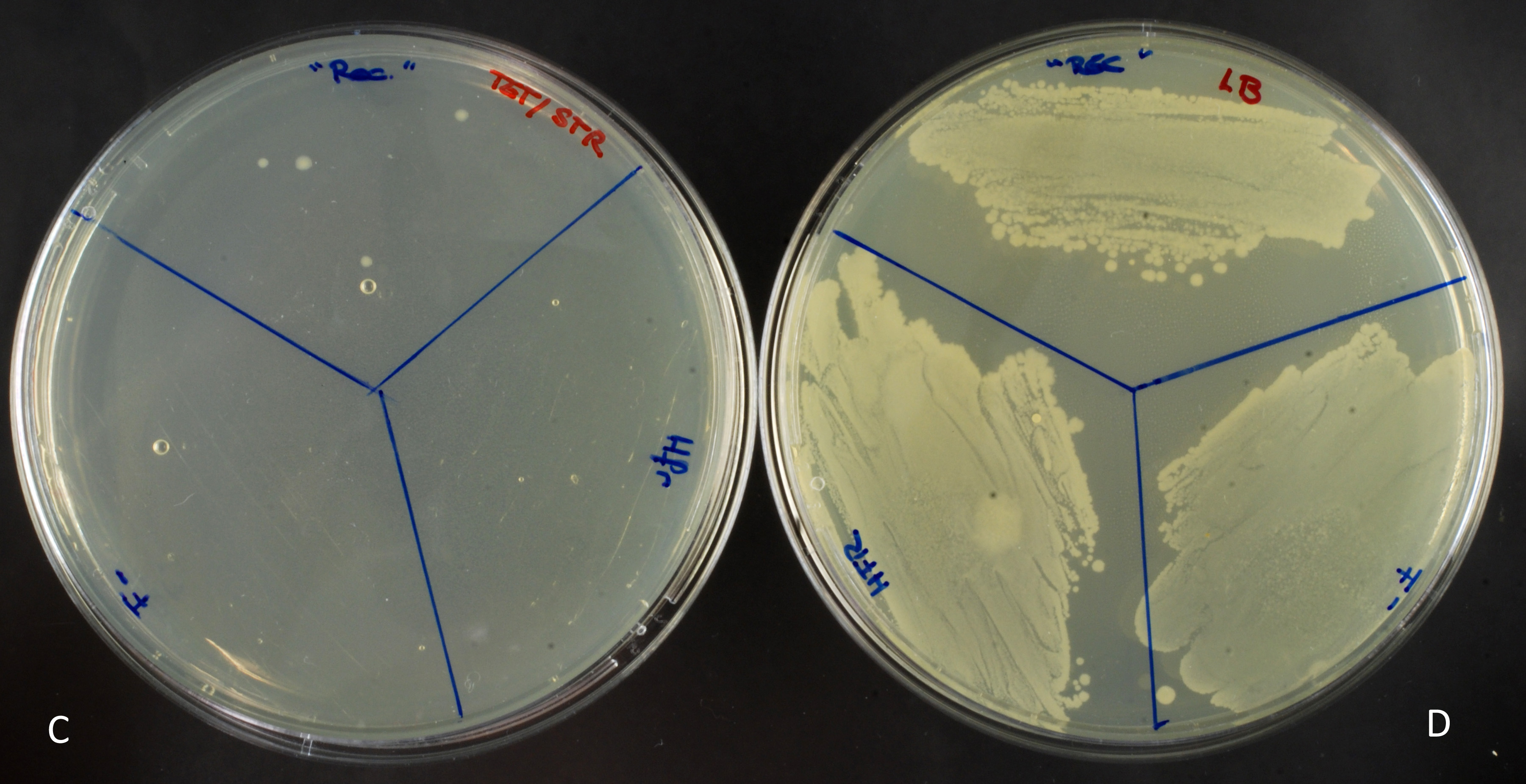
La souche Hfr, portant la résistance à la tétracycline, sera capable de pousser sur un milieu contenant cet antibiotique (fig.A) mais pas sur un milieu contenant de la streptomycine (fig.B). A l’inverse, la souche F-, portant elle la résistance à la streptomycine, poussera uniquement sur milieu avec streptomycine.
Le tube « conjugaison » (représenter par la partie « rec » sur les boites) contient les deux souches initiales, ainsi que les éventuels conjuguants qui porteraient une double résistance. Les milieux contenant un seul antibiotique permettent de faire pousser les souches initiales (hfr ou F-) ainsi que les conjuguants. (fig.A et B)
Sur le milieu contenant les deux antibiotiques (Fig.C) on n’observe que quelques colonies. La bactérie Hfr, lors de la conjugaison, a transféré, entre autre, son gène de résistance à la tétracycline à la bactérie F-, qui a pu l’intégré sur son propre chromosome, par recombinaison homologue. Ces conjuguants ont donc acquis une double résistance.
Expérience mise en place et proposée par Dr Bertrand Emery, enseignant au Collège Calvin
Matériel fourni:
- Souche E.coli Hfr
- Souche E.coli F-
- Milieu LB liquide
- Boite tubes Eppendorf 1,5 ml
- Portoir tube eppendorf
- Tubes plastique 15 ml
- Portoir tube 15/50 ml
- Boite de pétri LA + Tetracycline
- Boite de pétri LA + streptomycine
- Boite de pétri LA + Tetracycline + Streptomycine
- Micropipettes P1000
- Boîte de pointes bleues
Matériel non fourni:
- Etuve à 37°
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.