Cette expérience a été mise en place en collaboration avec le Dr. Erik Gullberg de l’Université d’Uppsala en Suède, qui nous a gracieusement fourni les souches utilisées pour cette activité.
Cette expérience est un complément à l’expérience 4. Transformation bactérienne.
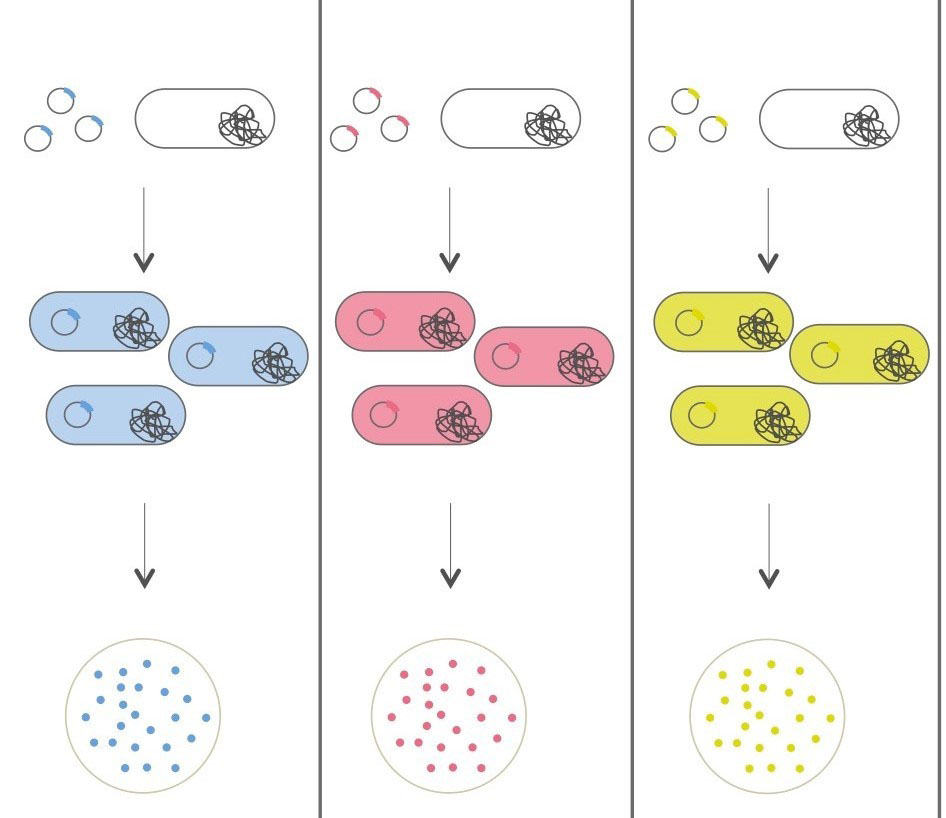
Bactéries pigmentées : Pour cette alternative, nous allons utiliser différents plasmides spécialement conçus pour induire la production d’un pigment, une chromoprotéine, rendant la colonie bactérienne colorée. Chaque plasmide contient une origine de réplication (ori) un gène de résistance à un antibiotique, la kanamycine (Kan), et un gène codant pour une chromoprotéine.
Le gène de résistance à la kanamycine code pour une enzyme qui inactive l’antibiotique, ainsi, seules les bactéries transformées avec l’un des plasmides seront capables de croître sur un milieu contenant l’antibiotique.
L'EXPERIENCE
Dans cette expérience, nous allons utiliser trois différents plasmides exprimant trois différentes chromoprotéines. Les gènes codant pour les chromoprotéines ont été initialement isolés de coraux marins.
Chromoprotéine bleue (plasmide pBO5) : Le gène amilCP codant pour cette chromoprotéine provient du corail Acropora millepora. Cette protéine a une absorbance maximum à 588 nm conférant une coloration bleue/violette.
Chromoprotéine rouge (plasmide pBO6) : Le gène mRFP1, donnant une coloration rouge, a été isolé de Discosoma sp., une espèce de coraux provenant de l’océan indien.
Chromoprotéine jaune (plasmide pBO7): Egalement issu du corail Acropora millepora, le gène amilGFP code pour une protéine donnant une forte coloration jaune quand il est exprimé.
|
Acropora millepora (pigment bleu) |
|
|
|
Discosoma sp. (pigment rouge) |
|
Acropora millepora (pigment jaune) |
|
PROTOCOLE
1/3 de la classe va utiliser le plasmide pBO5, 1/3 de la classe le plasmide pBO6 et 1/3 de la classe le plasmide pBO7.
Transformation
Prendre deux tubes de cellules compétentes et les noter + et -
Ajouter 8 µl du plasmide dans le tube marqué +
Mettre les deux tubes sur la glace pendant 15 minutes.
Incuber les tubes deux minutes à 42° (choc thermique)
Replacer ensuite les tubes dans la glace durant 5 minutes
Ajouter 1ml de LB dans chaque tube et incuber à 37° durant 30 minutes.
Déposer et étaler comme suite :
0,1 ml du tube + sur une boite LB+Kan
0,1 ml du tube + sur une boite LB
0,1 ml du tube - sur une boite LB+ Kan
0,1 ml du tube - sur une boite LB
Centrifuger le reste de la suspension 30 secondes à vitesse maximale pour faire tomber les cellules.
Enlever 0.7 ml de surnageant
Ressuspendre le culot avec le reste du surnageant et étaler ces 0.1 ml sur une boite LB+ Kan (uniquement pour le tube +)
Mettre les boites à 37° pendant 24h.
Resultats
plasmide pBO5 plasmide pBO6 plasmide pBO7
POUR ALLER PLUS LOIN (matériel en option)
Bio-art
Le Bio-art est une évolution relativement récente de l'art contemporain. Les artistes utilisent les ressources offertes par les biotechnologies, tel la culture de cellules, l'imagerie à résonnance magnétique ou encore la fluorescence, pour créer des oeuvres autour de thèmes parfois très controversés. Vous trouverez quelques exemples d'oeuvre de la bio-artiste Marta de Menezes sur ce lien.
A l'aide des trois souches de bactéries pigmentées, créez vos propre bio-oeuvres. Pour cela:
- Prendre trois tubes eppendorf que vous noterez respectivement rouge, jaune et bleu.
- Mettre 500ul d'eau dans chacun des tubes eppendorf
- A l'aide d'une anse, prélever une colonie rouge et la resuspendre dans le tube "rouge". Faite de même pour les deux autres.
- Prendre une boite de pétri et à l'aide d'un écouvillon stérile, dessiner ce qu'il vous plaira.
- Une fois votre dessin terminé, incuber la boite 24h à 37° puis admirer le résultat!
Note: Utiliser un écouvillon par tube.
Exemple de résultat

Matériel fourni:
- Micropipettes P20
- Micropipettes P200
- Micropipettes P1000
- Boîte de pointes jaunes
- Boîte de pointes bleues
- Boîte pipettes Pasteur pour les étalements
- Bloc chauffant
- Mini-centrifugeuse
- Portoir tube eppendorf
- Boite tubes Eppendorf 1,5 ml
- Cellules compétentes Escherichia coli
- Boîtes de Petri LA
- Boites de pétri LA + Kanamycine
- Plasmides pBO5, pBO6, pBO7
- Milieu LB liquide
- Ecouvillons
- Sac jaune pour les déchets
Matériel non fourni:
- CaCl2 (en option, pour préparation de cellules compétentes)
- Matériel supplémentaire pour BioArt (en option)
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.




