Les enzymes digestives sont des protéines produites par les organes du tube digestif pour réduire les aliments en fines particules (nutriments), afin que ceux-ci puissent traverser la barrière intestinale et passer dans notre sang. Les enzymes digestives sont d’une grande spécificité. Elles ne digèrent qu’un seul type d’aliment dans des conditions bien particulières.
Leurs découvertes datent du XIXème siècle : en 1836 Theodor Schwann étudiait les propriétés du suc gastrique sur la digestion des protides, alors qu’en 1848, Claude Bernard mettait en évidence le rôle des secrétions pancréatiques sur la dégradation des lipides. Mais ce n’est qu’au XXème siècle que ces enzymes furent isolées.
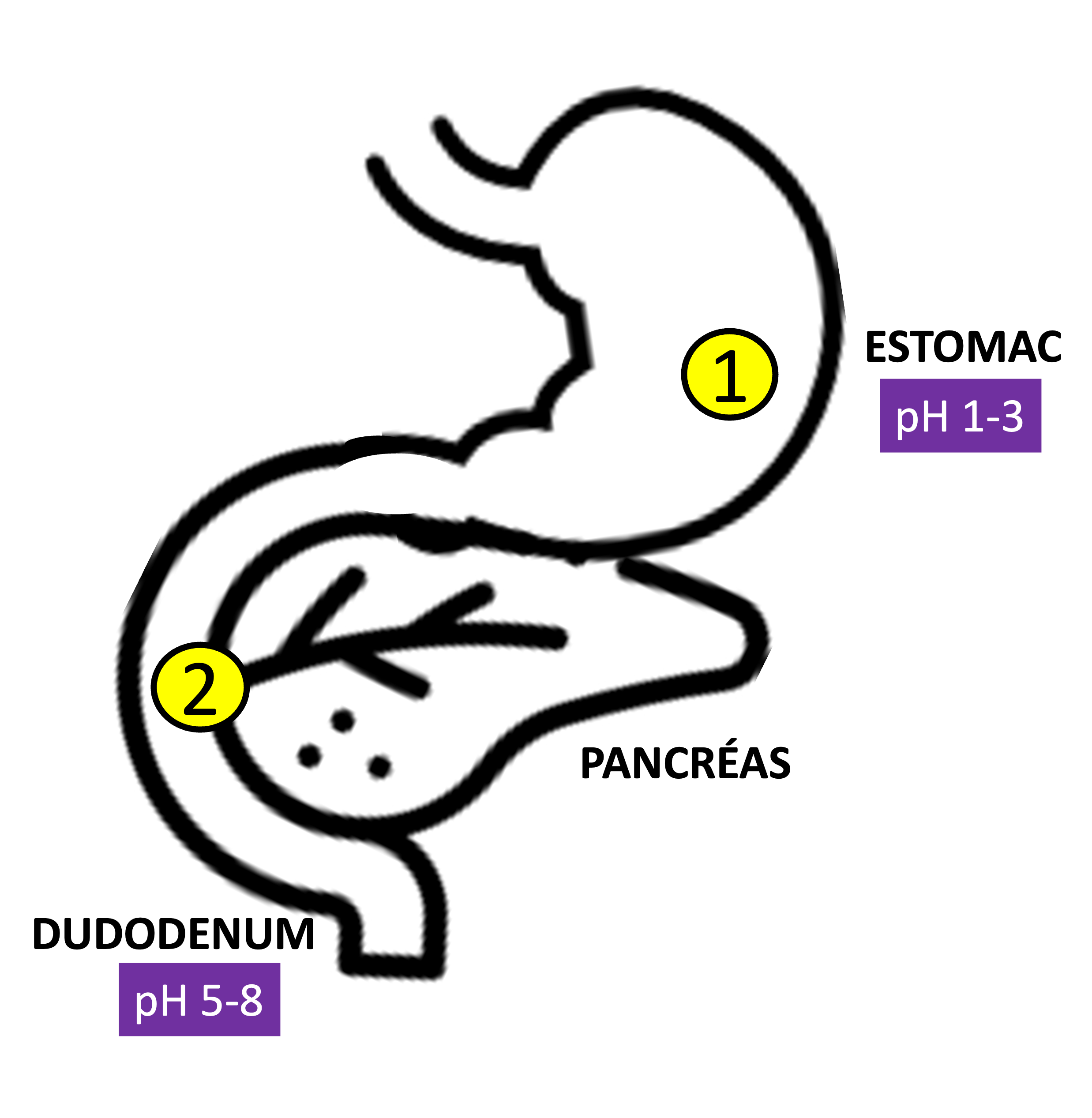
Schéma d’une partie de l’appareil digestif humain
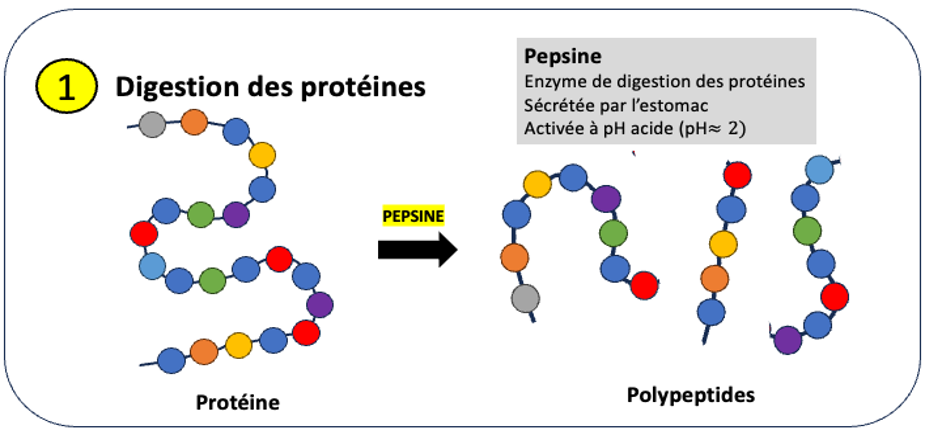
Les protéines sont des chaînes d’acides aminés. Une des enzymes impliquées dans leur digestion est la pepsine. Cette dernière est produite et stockée sous forme de pepsinogène inactive par les cellules principales de la muqueuse gastrique et excrétée directement dans l’estomac lors de la digestion. Elle est activée à pH acide dans l’estomac grâce à l’acide chlorhydrique produit par les cellules pariétales de la muqueuse gastrique. A l’issu de cette digestion, les protéines sont coupées en chaînes polypeptidiques plus courtes.
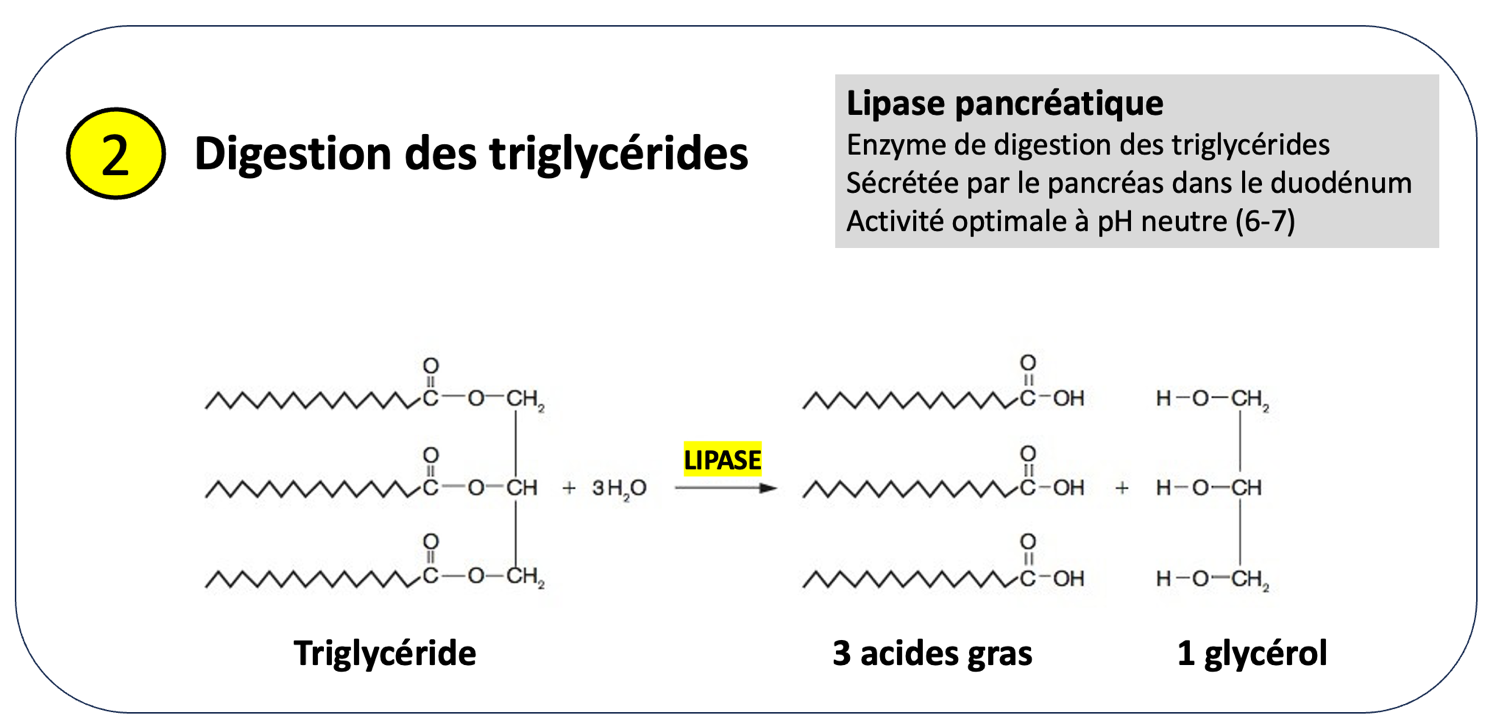
Les triglycérides sont une forme de lipides qui constituent d’excellentes molécules de stockage d’énergie. Ils sont constitués de 3 acides gras fixés sur une molécule de glycérol et sont digérés par des enzymes spécifiques, les lipases. Elles peuvent être produites par les glandes salivaires ou l’estomac mais c’est surtout la lipase pancréatique, produite par le pancréas et libérée dans le duodénum qui a la plus grande efficacité́.
Son activité́ est optimale à pH neutre. Ce sont les ions bicarbonates produit par le pancréas qui vont neutraliser l’acidité du bol alimentaire et permettre à la lipase pancréatique de scinder la molécule de triglycérides en acides gras et glycérol.
Thèmes : Enzymes digestives, protéines, lipides, digestion, nutriments, pH acide/alcalin.
A) Mise en évidence de l’activité de la pepsine
EXPERIENCE
Nous allons utiliser le blanc d’œuf qui contient de l’ovalbumine comme source de protéine pour notre expérience.
L’ovalbumine donne un aspect blanc laiteux à la solution avant sa digestion par la pepsine. Une fois digérée, l’aspect laiteux disparait et la solution devient transparente. La digestion de l’ovalbumine par la pepsine est donc facilement observable à l’œil nu.
PROTOCOLE
- Préparation d’une solution de blanc d’œuf.
Cette étape est à préparer au minimum la veille par l’enseignant.
- Faire bouillir 250 ml d’eau distillée.
- Ajouter un blanc d’œuf et mélanger vigoureusement de manière à obtenir une solution la plus homogène possible. La présence de petites particules de blanc d’œuf n’affecte en rien la suite de l’expérience.
- Compléter avec 250 ml d’eau distillée.
La solution est prête et peut être conservée plusieurs jours à 4°C.
- Digestion de l’ovalbumine par la pepsine
- Sortir la solution de blanc d’œuf du frigo afin qu’elle revienne à température ambiante.
- Préparer 5 tubes en verre et ajouter 9 ml de solution de blanc d’œuf dans chaque tube.
- Garder les tubes 1 à 4 à température ambiante et placer le tube n°5 dans la glace.
- Ajouter les réactifs en suivant les indications du tableau ci-dessous :
|
|
Tube 1 |
Tube 2 |
Tube 3 |
Tube 4 |
Tube 5 |
|
H2O |
1000 µl |
500µL |
|
500 µl |
|
|
HCl 1 M |
|
|
500 µl |
500 µl |
500 ul |
|
Pepsine 5mg/ml |
|
500 µl |
500 µl |
|
500 ul |
- Incuber les tubes 15 minutes à température ambiante.
Résultats
 |
 |
| T = 0min | T = 15min |
Après 15min de digestion, observer l’aspect des tubes et discuter des résultats.
B) Mise en évidence de l’activité de la lipase pancréatique
EXPERIENCE
Nous allons utiliser le lait comme source de triglycérides. Lors de leur digestion par la lipase, ils seront décomposés en glycérol et acides gras. Ces derniers vont acidifier la solution et donc faire baisser le pH.
Ainsi, plus la lipase est active plus le pH va diminuer.
L’activité de la lipase peut donc être suivie en mesurant l’évolution du pH de la solution grâce à un indicateur coloré, le rouge Crésol. A pH alcalin, l’indicateur est violet, il devient jaune à pH acide.
Dans le corps humain, la lipase pancréatique fonctionne en association avec une coenzyme – la colipase- qui permet de neutraliser l’acidification du milieu par les acides gras et les sels biliaires afin de garder un pH optimal à l’activité de la lipase. Dans notre expérience, nous utilisons la lipase seule car les conditions in vitro sont suffisantes à son activité.
PROTOCOLE
- Préparer 2 tubes en verre et ajouter les réactifs en suivant les indications du tableau ci-dessous :
|
|
Tube 1 |
Tube 2 |
|
Lait pH 9.5 |
2.5 ml |
2.5 ml |
|
H2O |
7.5 ml |
7 ml |
|
Lipase 15 mg/ml |
|
500 ml |
|
Rouge crésol 0,1% |
500 ml |
|
- Laisser incuber une vingtaine de minutes à température ambiante puis observer les résultats.
(Les tubes peuvent être mis à 37°C une dizaine de minutes pour une digestion plus rapide.)
Résultats
 |
 |
| T = 0min |
T = 20min |
Après 20min de digestion, observer l’aspect des tubes et discuter des résultats.
Cette expérience a été mise au point avec Irène Lelièvre, stagiaire chez BiOutils et en collaboration avec Mme Prisca Canola, enseignante au Collège Saint-Louis.
Matériel fourni:
- Tubes en verre
- Micropipettes P1000
- Boîte de pointes bleues
- Pipettes plastique 10 ml stériles
- Bouteille d'eau stérile
- HCl 1M
- Pepsine
- Lipase
- Lait pH 9,5
- Indicateur pH rouge crésol 0,1%
- Boite tubes Eppendorf 1,5 ml
- Portoirs pour tubes en verre
Matériel non fourni:
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.

